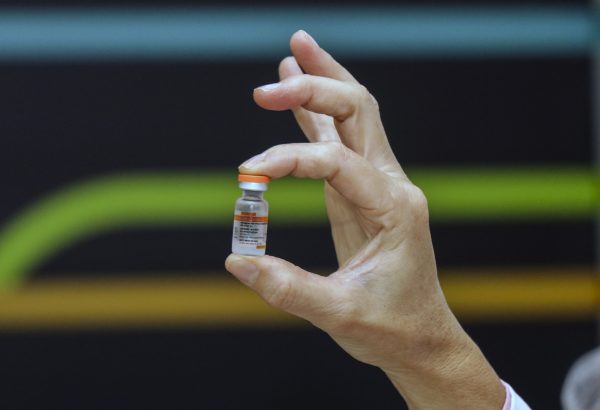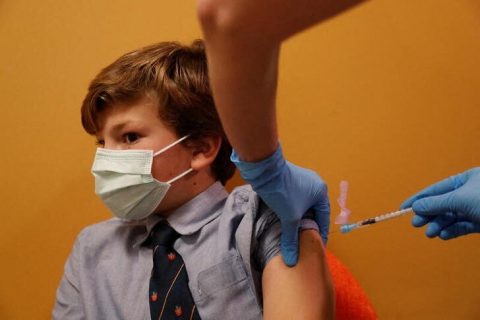
Pfizer testará 3ª dose de vacina contra Covid-19 em crianças

(Reuters) – A Pfizer e sua parceira alemã BioNTech SE disseram nesta sexta-feira (17) que incluirão e avaliarão uma terceira dose de sua vacina contra Covid-19 em um teste em andamento com crianças de seis meses a menos de cinco anos.
A decisão foi tomada depois que uma análise mostrou que a vacina de duas doses gerou uma reação imunológica na população de dois a menos de cinco anos de idade que foi inferior ao que se havia observado anteriormente entre pessoas de 16 a 25 anos.
Agora o estudo incluirá uma terceira dose de três microgramas administrada ao menos dois meses depois da segunda vacina do regime de duas doses para proporcionar níveis mais altos de proteção, disseram as empresas.
Se o estudo de três doses tiver sucesso, Pfizer e BioNTech esperam submeter dados a agências reguladoras para pleitearem uma autorização de uso emergencial para crianças de seis meses a menos de cinco anos na primeira metade de 2022.
A vacina recebeu aprovação para 16 anos e acima nos Estados Unidos em agosto. Ela também obteve autorização de uso emergencial para pessoas de cinco a 15 anos.
Na quinta-feira, as farmacêuticas solicitaram a aprovação total de sua vacina contra Covid-19 à Agência de Alimentos e Medicamentos dos EUA (FDA) para incluir adolescentes de 12 a 15 anos.
(Por Mrinalika Roy e Leroy Leo em Bengaluru)
No Ar
RIC Notícias Dia
As primeiras notícias do dia e os fatos mais marcantes do estado do Paraná, com Ana Vaz e Eduardo Scola.
🔴AO VIVOPróximos programas
- 14h50 Balanço Geral Curitiba
- 17h20 RIC Notícias Tarde